Miglioramento della produttività e riduzione degli antibiotici nei maiali vaccinati per via intradermica con un MLV di PRRSV1 in una fattoria positiva per PRRSV2 in Giappone
Pubblicazione di Joel Miranda et al. nell’IPVS 2024.
Introduzione
I vaccini possono ridurre l’esito clinico e l’impatto produttivo del Virus della Sindrome Riproduttiva e Respiratoria Suina (PRRSV)1,2, con due vie di somministrazione disponibili: intramuscolare (IM) e intradermica (ID). Il nostro obiettivo era valutare l’efficacia di due vaccini commerciali MLV per PRRS: uno basato su PRRSV1 (UNISTRAIN® PRRS, HIPRA; IM e ID) e l’altro su PRRSV2 (ceppo VR-2332; IM) in suini in crescita in una fattoria positiva per PRRSV2 in Giappone.
Materiali e metodi
A 3 settimane di età, 180 suinetti Kurobuta sono stati distribuiti uniformemente in tre gruppi e vaccinati con un MLV di PRRSV1 o un MLV di PRRSV2 (figura 1):
- gruppo V1_IM: vaccinato con UNISTRAIN® PRRS (intramuscolare)
- gruppo V1_ID: vaccinato con UNISTRAIN® PRRS (intradermico)
- gruppo V2_IM: vaccinato con ceppo VR-2332 (intramuscolare)
È stata valutata mensilmente la presenza di PRRSV nel sangue (RT-PCR) e la risposta umorale (CIVTEST® SUIS PRRS E/S e A/S) in tutti gli animali. Tra la vaccinazione (3 settimane di età) e la macellazione (6 mesi di età), è stata effettuata una valutazione dei segni clinici compatibili con PRRS, dell’uso di antibiotici e del guadagno di peso giornaliero medio. Inoltre, negli animali deceduti è stata verificata la presenza di PRRSV nei tessuti (RT-PCR). Le statistiche sono state eseguite utilizzando StatsDirect v2.7.7.

Figura 1 – Gruppi sperimentali. Da Miranda et al, 2024.
Risultati
Non sono state trovate ceppi del vaccino nel sangue dopo un mese; tuttavia, il ceppo PRRSV2MLV è stato trovato nei polmoni di un animale morto (47 dpv) appartenente al gruppo V2_IM. Dopo 14 dpv, il gruppo V1_ID ha mostrato significativamente meno giorni con segni clinici rispetto a V1_IM e V2_IM (36 < 74 e 77, rispettivamente; p<0.05) (figura 2a).
Il numero cumulativo di giorni con iniezioni individuali di antibiotici è stato il più basso nel gruppo V1_ID (38 giorni per V1_ID < 87 giorni per V1_IM e 84 giorni per V2_IM; p<0.05) (figura 2b).
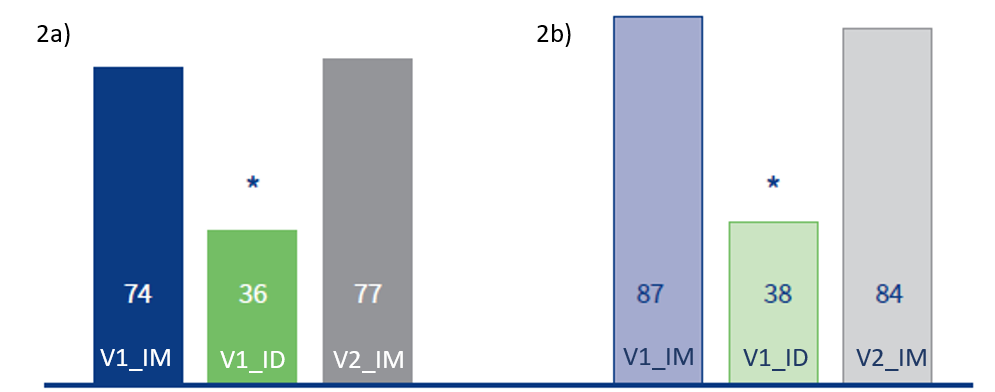
Figura 2 – Numero di giorni con segni clinici compatibili con PRRSV (2a) e numero di giorni in cui è stato applicato trattamento antibiotico (2b). Adattato da Miranda et al, 2024.
Durante il primo mese post-vaccinazione, il gruppo V1_ID ha mostrato un incremento di peso significativamente superiore a V1_IM e V2_IM (286.0 > 235.0 e 234.7 g/giorno, rispettivamente; p<0.05) (tabella 1). Sono stati rilevati anticorpi contro PRRSV2 in tutti i gruppi, indicando la circolazione di ceppi di campo di PRRSV2.
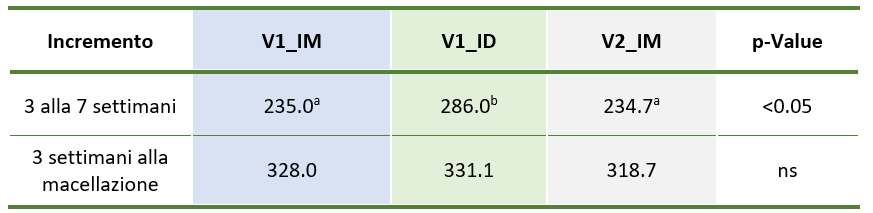
Tabella 1 – Incremento di peso (gr/giorno): il gruppo V1_ID ha mostrato una crescita significativamente maggiore durante il primo mese dopo la vaccinazione. Adattato da Miranda et al, 2024.
Discussione e conclusione
Nonostante le differenze genetiche, PRRSV1_MLV IM e PRRSV2_MLV hanno fornito una protezione simile in una fattoria positiva per PRRSV2. Al contrario, è stato ottenuto un miglior risultato utilizzando PRRSV1_MLV ID, suggerendo che la vaccinazione ID è una strategia efficace per il controllo del PRRS. Ulteriori vantaggi dell’uso della via ID sono l’evitamento della trasmissione iatrogénica di patogeni e meno stress e dolore3.
Oltre alla via di somministrazione, questi risultati potrebbero essere spiegati dalle proprietà immunologiche dei ceppi coinvolti4 e dall’interferenza con gli anticorpi materni durante la vaccinazione5, poiché le scrofe venivano vaccinati regolarmente con il vaccino PRRSV2.
Se vuoi leggere altre pubblicazioni sulla PRRS: PRRS Control Publications
Riferimenti:




